| 我校生物与医学工程学院史向阳教授团队 在癌症诊疗纳米医学方面取得系列重要研究进展 |
| 发布人:张莹 发布时间:2022-09-29 浏览次数:10 |
|
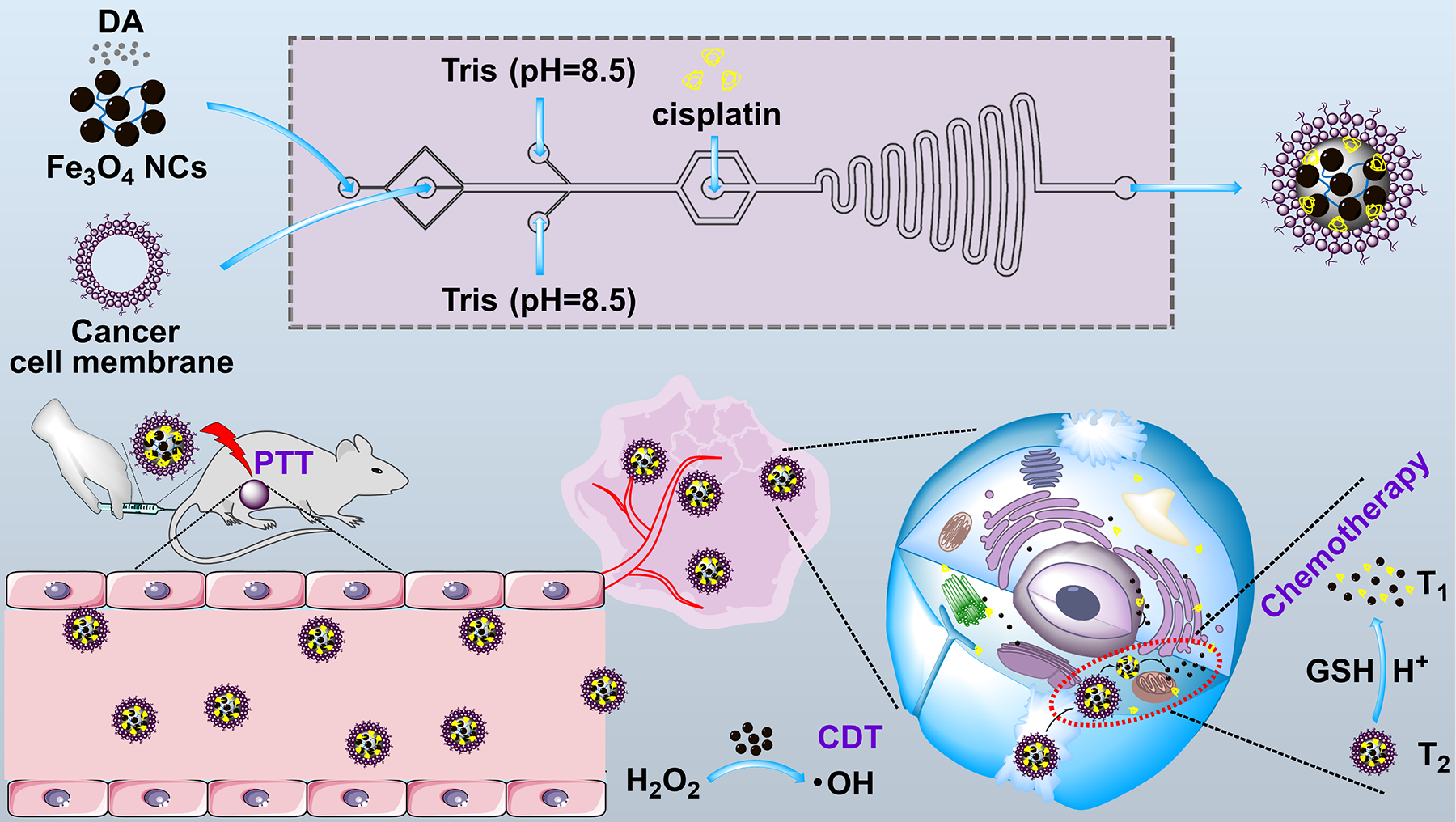
近日,我校生物与医学工程学院史向阳教授团队在癌症诊疗纳米医学方面取得系列重要研究进展,相关成果分别发表于国际知名期刊《今日纳米》(Nano Today)和《先进材料》(Advanced Materials)。该系列工作得到了国家自然科学基金委、国家自然科学基金国际(地区)合作与交流项目、上海市科委政府间国际合作项目及中央高校研究生创新基金等项目的资助。 临床肿瘤治疗中,兼备无创性和全身抗肿瘤能力的化疗仍是主要方法,但肿瘤部位复杂的生理和病理障碍严重制约着临床化疗效果。在开发新型智能诊疗纳米平台时,需要考虑多种障碍,主要包括免疫抑制的肿瘤微环境(TME)、免疫清除、网状内皮系统(RES)引起的滞留效应、高间质液压力、血管渗漏和淋巴引流不良等。为了克服免疫和RES器官清除,由于癌细胞膜(CCM)上存在免疫片段、抗原和膜锚蛋白,多种CCM包裹的仿生纳米平台被赋予了免疫逃逸和同源肿瘤靶向能力。另外,探索可有效诱导肿瘤免疫原性的新化疗靶点,激活免疫系统并逆转TME的免疫抑制性,有望实现增强的治疗效果。为了实现精准的成像诊断、有效的肿瘤给药和降低全身毒副作用,设计TME(酸性pH、过量谷胱甘肽(GSH)等)刺激响应性释放药物的智能纳米药物尤为关键。同时,考虑到对肿瘤的联合治疗可能会引起肿瘤细胞表面免疫检查点分子表达增加,将联合治疗与免疫检查点阻断(ICB)疗法结合将有望逆转免疫抑制的TME并产生长期抗肿瘤免疫记忆效应。 相比传统合成的纳米药物开发,微流控技术能够通过在微米尺度空间操控微流体进行反应,可以精确控制纳米平台的合成过程,包括成核、生长和聚集。微流控作为一种很有前途的技术,具有试剂损耗低、可控制备和一步合成等特点,在合成高质量纳米平台方面具有相当的优势,能极大助力纳米药物的临床转化。史向阳教授团队首先基于微流控技术开发了CCM包覆的负载顺铂的聚多巴胺超小氧化铁纳米团簇(FDPC NCs)用于肿瘤微环境刺激响应的动态磁共振成像导引的肿瘤联合治疗(图1)。该研究设计的FDPC纳米平台的主要优势在于以下几个方面:(1)与传统湿化学方法制备的类似物相比,基于微流控的方法制备的FDPC纳米平台具有更好的均一性、胶体稳定性和TME刺激药物释放性能;(2)通过二硫键的断裂消耗GSH和基于超小铁介导的ROS生成,调控肿瘤微环境,降低癌细胞的抗氧化能力,促使癌细胞对药物和ROS敏感,减少毒副作用;(3)FDPC纳米平台具有良好的同源靶向性能、光热性能和GSH响应的MR成像性能,可用于靶向肿瘤GSH响应的动态T2/T1 MR成像和联合治疗。本研究为高质量纳米药物的可控制备及肿瘤的精准诊疗提供了新的思路。该成果以《增强肿瘤微环境调控型智能超小氧化铁纳米团簇的微流控合成及其动态磁共振成像引导的肿瘤光热/化学/化学动力学治疗》(Microfluidic synthesis of intelligent nanoclusters of ultrasmall iron oxide nanoparticles with improved tumor microenvironment regulation for dynamic MR imaging-guided tumor photothermo-chemo-chemodynamic therapy)为题,发表于国际知名期刊《今日纳米》(Nano Today)(https://doi.org/10.1016/j.nantod.2022.101615),生物与医学工程学院博士研究生杨瑞为第一作者,史向阳教授为通讯作者。
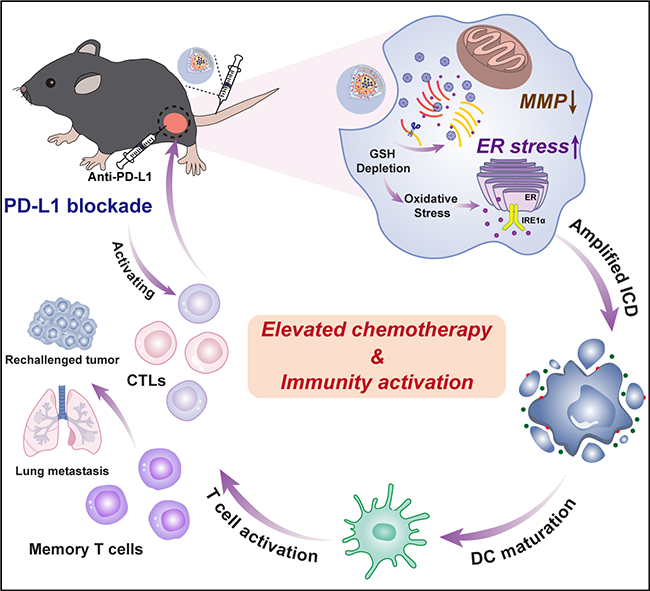
图1. FDPC的微流控制备及其用于动态T2/T1 MR成像引导的肿瘤光热-化学-化学动力学三模态联合治疗的示意图。 其次,为了进一步探索联合治疗与ICB的联合优势,史向阳教授团队制备了细胞膜仿生、负载了1G3-Cu和内质网应激药物丰加霉素(Toy)的还原响应型聚合物纳米胶束用于化疗增强的肿瘤免疫治疗(图2)。研究团队首先利用含有二硫键的两亲性聚合物(PEG-SS-PCL)形成胶束,将1G3-Cu包封在其疏水空腔,并通过氢键作用负载Toy,最后在其表面包覆B16黑色素瘤细胞膜(CM),得到还原响应的聚合物纳米颗粒(GCT@CM NPs)。该研究设计的GCT@CM NPs纳米平台具有多个优势:(1)构建的NPs联合CM显著提高了1G3-Cu和Toy的生物利用度并降低了它们的副作用,使1G3-Cu和Toy在TME中响应性释放,从而通过线粒体和内质网应激两个途径诱导肿瘤细胞凋亡;(2)Toy介导的内质网应激放大可以与1G3-Cu诱导的线粒体功能障碍协同作用,增强ICD效应,熟化DCs并招募免疫细胞进入TME;(3)GCT@CM NPs与Anti-PD-L1联合使用,可产生长期免疫应答,抑制肿瘤的复发和转移。本研究制备的GCT@CM NPs为整合不同的治疗靶点以实现化疗增强的免疫治疗提供了新的思路。该研究成果以《仿生聚合物纳米颗粒通过放大内质网应激和诱导线粒体功能障碍的化疗增强肿瘤免疫治疗》(Biomimetic Polymeric Nanoparticle-Mediated Chemotherapy Potentiates Enhanced Tumor Immunotherapy via Amplification of Endoplasmic Reticulum Stress and Mitochondrial Dysfunction)为题,在线发表于国际知名期刊《先进材料》(Advanced Materials)(https://doi.org/10.1002/adma.202206861)。生物与医学工程学院博士生郭云琦和范钰为共同第一作者,史向阳教授与沈明武教授为共同通讯作者。
图2. GCT@CM NPs的应用示意图。 据了解,我校生物与医学工程学院自成立以来,积极推进有组织科研,在健康中国战略背景下,围绕上海发展生物医药等三大先导产业,积极布局生物材料与医疗器械、重大疾病诊疗与疫情防护、人工智能与智慧医疗、合成生物学等学科方向和研究领域,通过全面加强学院创新机制和创新团队建设,以更高质量、更大贡献服务国家战略需求。 信息员:崔启璐 |